Faz Diyagramı – İş Sağlığı ve Güvenliği Tez Yaptırma – İSG – İş Sağlığı ve Güvenliği Tez Yaptırma Ücretleri
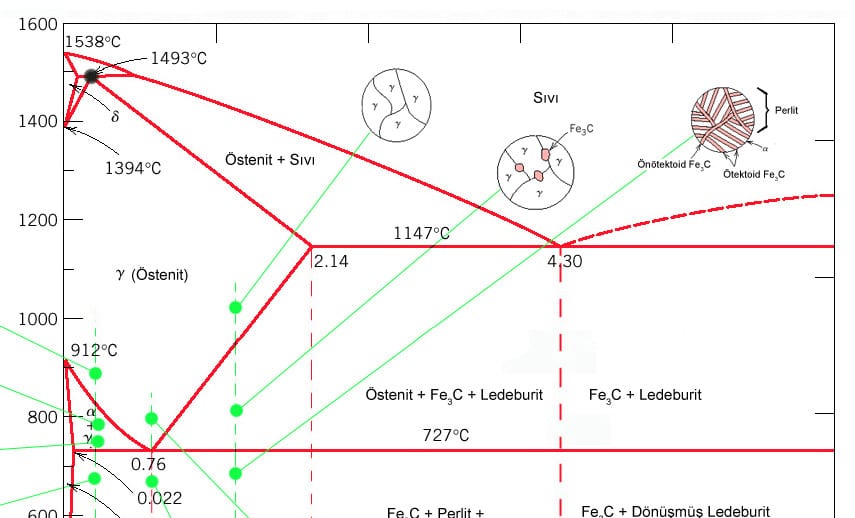
Faz Diyagramı
Düşük sıcaklık ve yüksek basıncın etkisi altında bir kriyojenik sıvıya sahip olduğunuzda, sıvıdan gaza dönüşümün hacim-hacim genleşme oranı (bir sıvının buharlaşarak gaza dönüşme eğilimi) olacaktır. kimyasal açığa çıkar. Bir tehlikeli madde olayı için, referans şube bu oranı ve olay yerini nasıl etkileyebileceğini araştırmaya hazır olmalıdır.
Bir yangın potansiyelinin yanı sıra hacim genişleme oranları mevcut olduğunda, sağlık tehlikeleri olacaktır. Genleşme oranları, bir kaptaki sıkıştırılmış gaz veya sıvılaştırılmış gaz hacminin, kabın dışındaki gerçek gaz hacimlerine oranıdır. Genel bir kural olarak, sıcaklık düşüşü olmayan (kriyojenik olmayan) sıvılaştırılmış gazların genleşme oranları 1 ila 200–300 olacaktır.
Kriyojenik sıvılar, 1 ila 600–1000+ aralığında (nitrojen için 696 ila neon için 1445) büyük genişleme oranlarına sahiptir. Kriyojeniklerin bulunduğu aşırı düşük sıcaklıklardan dolayı diğer gazları, sıvıları veya yarı katıları sıvılaştırabilir veya katılaştırabilirler. Genleşme oranları ve aşırı düşük sıcaklıklar arasında, bu ürünler önemli bir sağlık tehlikesi arz etmektedir.
Kriyojenik teknik tanımı, kaynama noktası 1 atm’de –130°F’den daha düşük olan gazlara uygulanır. Kriyojenikler, sıvı hale zorlanmış malzemelerdir. Serbest bırakıldığında, bu sıvı doğal durumuna geri dönecektir: bir gaz. Bir birey bu durum değişikliği alanında olduğunda bir tehlike ortaya çıkar.
Görülen tipik yaralanmalar travmatik ve hipotermik yaralanmalardır. Açıktır ki, kriyojenik maddenin soğuk doğası, dokunun kendisinde donma veya donma meydana getirecektir. Ani salınım travmatik yırtılmalara ve buna bağlı olarak absorpsiyon veya enjeksiyon yoluyla kimyasal maruziyete neden olabilir.
Bu sıvı gaz haline geri dönmek için ısındığında, kimyasalın hacmi çoğalır. Hacimdeki artış hızı, kaynama noktası gibi fiziksel özelliklerine bağlıdır. Sıvı halden buhar haline hızlı genişleme aynı zamanda VP’de bir artışa neden olacaktır, bu da olay sırasında solunum emiliminin tehlike değerlendirmelerini daha da arttırır.
Genleşme oranı, gaz fazındaki aynı miktardaki malzemenin hacmine kıyasla sıvı fazdaki hacimdir. Bu, sıvı fazın tipik yoğunluğunu alarak ve bunu gaz fazında tanımlanmış bir sıcaklıkta gaz fazının yoğunluğuna bölerek hesaplanabilir.
Genleşme oranlarının hesaplanmasına bir örnek olarak: bir dewar (kriyojenik karbon dioksit) içindeki sıvı CO2, 150 psig’lik bir basınçla yaklaşık –35°F’dedir. 68.74 lb/ft3 sıvı yoğunluğuna sahiptir. Bu, 0.115 lb/ft3 gaz yoğunluğuna sahip 70°F’ye buharlaştırılırsa, genişleme oranı 68.74/0.115 = 598 veya kabaca 600:1 olacaktır.
İyon-Dipol Etkileşimi
Saf maddelerde bulunan aynı moleküller arası kuvvetler karışımlarda da bulunabilir. Bunun nedeni, saf bir maddedeki benzer moleküller arasında var olan etkileşimlerin aynısının bir karışımdaki farklı moleküller arasında da var olabilmesidir. Karışım sadece polar olmayan malzemelerden oluşuyorsa, karışımda sadece dağılma kuvvetleri mevcuttur. Bir karışım polar maddelerden oluşuyorsa, dipol-dipol etkileşimleri mevcuttur. Bir bileşen bir O-H, N-H bağı içeriyorsa veya bir bileşen HF ise, hidrojen bağı mevcuttur.
Karışımlarda bulunabilecek ek bir moleküller arası kuvvet vardır. Bir karışım, polar bir çözücüde (bir çözeltinin en bol bulunan bileşeni) çözülmüş iyonik bir bileşikten oluşuyorsa, çözeltinin oluşumundan sorumlu etkileşime iyon-dipol etkileşimi denir. İyonik bileşikler ve polar sıvılar arasında iyon-dipol etkileşimi mümkündür.
Sodyum klorür suda çözülmediğinde ne olduğunu düşünün. Her pozitif yüklü sodyum iyonu, polar su molekülünün negatif ucuyla çevrilidir. Sudaki oksijen atomları kendilerini sodyuma yönlendirir. Negatif yüklü her klorür iyonu, suyun pozitif ucuyla çevrilidir. Sudaki hidrojen kendisini klorüre doğru yönlendirir. Kısmen yüklü su molekülleri ile sodyum klorür içeren gerçek iyonlar arasındaki bu etkileşim, iyon-dipol etkileşimidir.
Suyun faz diyagramı
Ötektik faz diyagramı
Suyun faz diyagramı ve yorumlama
Faz diyagramı nedir
Cu Ag faz diyagramı
Suyun faz diyagramı neden farklı
Basınç sıcaklık faz diyagramı
Karbondioksitin faz diyagramı
Çözelti Oluşumunun Enerjileri
Bir çözelti birden fazla malzemeden oluşur. Çözümler baştan sona aynıdır veya homojendir ve her bileşen aynı fazdadır. Bir karışımın bir çözeltiyle sonuçlanması için, karışımın bileşenleri arasında var olan moleküller arası kuvvetlerin, saf malzemelerde var olanlara yakın olması gerekir. Karışım bileşenleri arasındaki etkileşimlerin toplam kuvvetinin, saf malzemelerdeki etkileşimlerin kuvvetinden daha büyük olması gerekmediğine dikkat etmek önemlidir.
Bunun nedeni, karıştırmaya yönelik doğal bir eğilim olmasıdır. Saf malzemeler karıştırıldığında, entropide bir artış olur ve Termodinamiğin İkinci Yasasına göre sistemler kendiliğinden entropiyi artıracak şekilde davranır. Entropi, bir sistemin düzensizliğinin bir ölçüsüdür. Bu bozukluk, bir sistem içindeki potansiyel farklı düzenleme sayısını ifade eder.
Moleküller arası etkileşimleri kırmak için ısı gereklidir. Yeni etkileşimler oluştuğunda ısı kazanılır. Yeni etkileşimler yapıldığında, saf malzemeler içindeki moleküller arası kuvvetleri kırmak için gerekenden daha fazla ısı açığa çıktığında, sonuç net bir ısı salınımı olur ve süreç ekzotermik olarak kabul edilir.
Saf malzemelerde var olan moleküller arası etkileşimleri kırmak için, karışım bileşenleri arasında yeni etkileşimler oluştuğunda açığa çıkandan daha fazla ısı gerektiğinde, net bir ısı absorpsiyonu vardır ve sürece endotermik denir.
Bir yaralanmayı tedavi etmek için bir buz paketini kırdığınızda, amonyum nitratın suda çözünmesine neden oluyorsunuz. Bu özel çözünme işlemi, açığa çıkandan daha fazla ısının emilmesini gerektirdiğinden (endotermik), ısı çevreden alındığında buz paketi soğur.
Ekzotermik süreçler ve reaksiyonlar çevreye ısı verir ve bize sıcak gelir. Endotermik süreçler ve reaksiyonlar çevreden ısıyı emer ve bize soğuk gelir.
Hem saf maddelerde hem de tuzlu su çözeltisinde bulunan tüm etkileşimleri karakterize etmeye yardımcı olması için sodyum klorürün suda çözünmesini düşünün. Sodyum klorür iyonik bir bağ ile bir arada tutulur. Her pozitif yüklü sodyum iyonu, her negatif yüklü klorür iyonuna elektrostatik olarak bir arada tutulur. Su polardır.
Saf su örneğindeki baskın kuvvet hidrojen bağıdır. Bir tuzlu su çözeltisinin oluşması için, sodyum iyonları ile su ve klorür iyonları ile su arasında yeni iyon-dipol etkileşimlerinin oluşmasına izin vermek için sodyum klorürdeki iyonik bağ ve sudaki hidrojen bağlarının kırılması gerekir.
Basınç sıcaklık faz diyagramı Cu Ag faz diyagramı Faz diyagramı nedir Karbondioksitin faz diyagramı Ötektik faz diyagramı Suyun faz diyagramı Suyun faz diyagramı neden farklı Suyun faz diyagramı ve yorumlama







Son yorumlar