İyonik Bağ – İş Sağlığı ve Güvenliği Tez Yaptırma – İSG – İş Sağlığı ve Güvenliği Tez Yaptırma Ücretleri
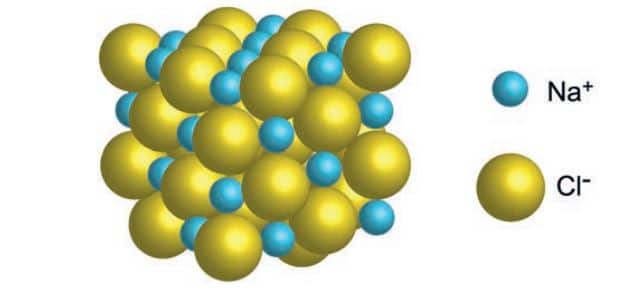
İyonik Bağ
İyonik bileşikler sadece metal katyonları ve ametal anyonlar arasındaki bileşikler değildir. İyonik bileşikler, herhangi bir katyon ve anyon arasındaki çekim ile oluşan bileşiklerdir. Bazı katyonlar ve anyonlar birden fazla atom içerir. Bunlara çok atomlu iyonlar denir.
Çok atomlu iyonları içeren atomlar birbirine kovalent olarak bağlanır, ancak daha sonra proton sayısından daha az veya daha fazla elektrona sahip olur ve bu da genel bir yük ile sonuçlanır.
Çok yaygın tek bir çok atomlu katyon vardır: amonyum veya NH4+. İyonik bir bileşikteki katyon ya bir metal ya da amonyum olduğundan, bir iyonik bileşiği bir metal ya da amonyum arayarak tanımak genellikle en kolayıdır. İkisinden birini bulursanız, bileşiğin iyonik olduğunu bilirsiniz.
Çok atomlu anyonlar vardır. Çok atomlu anyonlar, birbirine kovalent olarak bağlı birden fazla atomdan oluşur, ancak protonlardan daha fazla elektrona sahiptir ve bu da genel bir negatif yük ile sonuçlanır. Toplam yükün büyüklüğü, ek elektronların sayısına bağlıdır. Genellikle çok atomlu anyonların adlarını, formüllerini ve toplam yüklerini basitçe ezberlemek gerekir.
Teknik not
Amonyum dışında başka çok atomlu katyonlar da vardır. Çoğu, bir amine bir proton eklenmesi sonucu oluşur. Örneğin, dimetilamin bir asit-baz reaksiyonunda protonlanırsa, sonuç dimetilamonyumdur. Dimetilamonyum daha sonra iyonik bir bileşik oluşturmak için bir anyona bağlanabilir. Birçok poliatomik katyon, amonyum değilse de adında “amonyum” içerir.
İyonik bir bileşiğin formülünü tahmin ederken, tüm bileşiklerin elektriksel olarak nötr olduğunu bilmek önemlidir. Bu, katyonlar ve anyonların toplam sıfır yüküyle sonuçlanan oranda birleştiği anlamına gelir. Herhangi bir iyonik bileşiğin formülünü belirlerken aşağıdaki adımlar gerçekleştirilir:
- Adım 1. Bileşiği iyonik olarak tanıyın (bir metal veya bir amonyum formu içerir).
- Adım 2. Katyon ve anyonun yüklerini belirleyin. Adım 3. Elektriksel olarak nötr bir bileşik ile sonuçlanan oranı tanımlayın.
Örneğin, kalsiyum klorürün kimyasal formülünü belirlemek için, önce kalsiyumun 2. grupta olduğu için +2 yüklü bir katyon olacağı anlaşılır. Klor 17. grupta olduğundan, yükü -1 olan bir iyon olacaktır. +2 yüklü 1 türü dengelemek için yükü -1 olan iki türe ihtiyacınız olduğundan, kalsiyum klorür formülü CaCl2’dir.
Kovalent bağ
En Güçlü iyonik bağ
Kimyasal bağlar ve özellikleri
Kovalent bağ Özellikleri
Kimya adası iyonik bağ
Fe metali iyonik bağ mı
Bileşiklerden hangisi iyonik bağlıdır
Kovalent bağ kimler arasında olur
Çok atomlu anyonlar içeren iyonik bileşikler için çok atomlu iyonların formüllerini ve yüklerini öğrenmek gereklidir. Sodyum karbonatın formülünü belirlemek için, önce bir metal olan sodyum içerdiğinden bileşiği iyonik olarak tanırsınız. Periyodik tablonun 1. grubunda olduğu için sodyum yükünü +1 olarak tanımlarsınız.
Ardından, formülün geri kalanını bulmak için karbonatın kimliğinin CO32− olduğunu bilmeniz (veya aramanız) gerekir. Karbonatın kimliği bilindiğinde, +1 yüklü iki sodyum iyonunun -2 yüklü karbonatı dengelediğini bilirsiniz.
Uyarı
İyonik bileşiklere genellikle tuzlar denir. Tuzların farkında olun:
• Suda çözülür
• Suda çözündüğünde elektriği iletir
• Zehirli olabilir
• Yüksek erime noktalarına sahip katılardır
• Normal koşullarda yakmayın.
Kovalent Bağ
Kovalent bağ, elektronları paylaşan iki atomun sonucudur. Elektron paylaşması muhtemel atomların tam bir değerlik kabuğu elde etmek için sadece birkaç taneye daha ihtiyacı olacağından, ametaller arasında kovalent bağlar oluşur. Örnek olarak, iki atom içeren moleküller olarak var olan elementleri ele alalım. Klor gazı buna bir örnektir. Periyodik tablodaki konumuna dayanarak, klorun değerlik kabuğunun, dolu olması gerekenden bir tane daha az elektron içerdiğini söyleyebilirsiniz.
Klor stabiliteyi iki şekilde sağlayabilir. Sodyum ile reaksiyona girdiğinde olduğu gibi bir elektron kazanabilir; bu durumda negatif yüklü olur ve iyonik bir bağa katılır. Klorun stabilite elde etmesinin diğer yolu bir elektron paylaşmaktır. Temel klor durumunda, her klor atomunun kararlılık için yalnızca bir elektrona ihtiyacı vardır. Bu nedenle, her atom bir elektronu başka bir atomla paylaşacaktır. Sonuç, bağın bir çift içerdiği bir kovalent bağdır.
Molekül, iki veya daha fazla atomdan oluşan ve o maddenin tüm özelliklerini koruyan bazı maddelerin en küçük birimidir. Molekül başına iki atom bulunan ve var olan elementler hidrojen, nitrojen, oksijen, flor, klor, brom ve iyottur. Oksijen ve nitrojen molekülleri sırasıyla ikili ve üçlü kovalent bağ içerir.
Periyodik tablodaki konumlarından oksijenin iki değerlik elektronuna ve azotun üç değerlik elektronuna ihtiyacı olduğuna dikkat edin. Bu nedenle, bir oksijen molekülünde, her oksijen bir çift bağ oluşturmak için iki elektron paylaşacak ve bir azot molekülünde, her atom üçlü bir bağdan üç elektron paylaşacaktır. İkinci yapı bir Lewis yapısıdır. Bir Lewis yapısında, bağ elektron çiftleri, atomları birbirine bağlayan çizgilerle temsil edilir.
Elektronlar paylaşıldığında, sadece bazen eşit olarak paylaşılırlar. Bu, klor gazı için geçerli olacaktır. Bağa katılan her bir atom, elektronlar için diğeriyle aynı nispi çekime sahip olduğundan, elektronlar iki atom arasında eşit olarak dağıtılır. Elektronlar eşit olarak dağıldığında, kovalent bağın polar olmadığı söylenir. Elektronları aynı şekilde çeken iki atom arasındaki bağ polar değildir. Bu, bağa dahil olan iki atom aynı olduğunda her zaman böyle olacaktır.
Çoğu zaman, bir kovalent bağda paylaşılan elektronlar eşit olarak dağılmaz. Bir kovalent bağa dahil olan atomlar birbirinden farklı olduğunda, genellikle bir atom elektronları diğerinden daha güçlü bir şekilde çeker. Bu durumda elektronlar daha elektronegatif atoma daha yakındır ve bağın polar olduğu söylenir.
Atom’dan hatırlayın, elektronegatiflikler bir satırda (soy gazlar hariç) ilerlerken artar ve periyodik tablonun bir sütununda aşağı inerken azalır. Genel olarak, bir kovalent bağdaki elektronları hangi atomun daha güçlü çekeceğini periyodik tabloya yerleştirerek anlayabilirsiniz. Flor en elektronegatif atomdur. Flordan uzaklaştıkça atomlar daha az elektronegatif olur.
Bileşiklerden hangisi iyonik bağlıdır En Güçlü iyonik bağ Fe metali iyonik bağ mı Kimya adası iyonik bağ Kimyasal bağlar ve özellikleri Kovalent bağ Kovalent bağ kimler arasında olur Kovalent bağ Özellikleri







Son yorumlar